JYNNEOS è l’unico vaccino approvato dall’FDA nel 2021 indicato per la prevenzione della malattia del vaiolo e del vaiolo delle scimmie in adulti di età pari o superiore a 18 anni ritenuti ad alto rischio di infezione da vaiolo o vaiolo delle scimmie.
Andiamo a guardare il foglio illustrativo.
Innanzitutto leggiamo che i soggetti immunocompromessi potrebbero avere una risposta immunitaria ridotta, come ci si aspetterebbe e nei limiti dell’efficacia ci avvisa che potrebbe non funzionare su alcuni soggetti quindi non proteggere tutti i destinatari.
Sembrano banalità, ma di questi tempi occorre tenere nota di queste informazioni:

LA SPERIMENTAZIONE
“Poiché gli studi clinici sono condotti in condizioni molto diverse, i tassi di reazioni avverse osservati negli studi clinici di un vaccino non possono essere confrontati direttamente con quelli degli studi clinici di un altro vaccino e potrebbero non riflettere i tassi osservati nella pratica. Esiste la possibilità che un ampio uso di JYNNEOS possa rivelare reazioni avverse non osservate negli studi clinici.
Il programma complessivo di sperimentazione clinica comprendeva 22 studi e un totale di 7.859 individui.
18-80 anni di età che hanno ricevuto almeno 1 dose di JYNNEOS (7.093 soggetti naïve al vaccino antivaioloso e 766 soggetti con esperienza di vaccino antivaioloso)”
Quindi abbiamo una risicata sperimentazione e la possibilità di osservare reazioni avverse sconosciute a seguito di UN AMPIO USO.

La sicurezza di JYNNEOS in soggetti naïve al vaccino antivaioloso è stata valutata nello Studio 1 [1], uno studio randomizzato, in doppio cieco, controllato con placebo, condotto negli Stati Uniti, in cui adulti naïve al vaccino di età compresa tra i 18 e i 40 anni hanno ricevuto due dosi di JYNNEOS (N=3003), oppure due iniezioni di soluzione fisiologica tamponata con Tris (placebo, N=1002) a distanza di quattro settimane.
Nella popolazione totale dello studio, l’età media era di 28 anni; il 47,9% dei soggetti era di sesso maschile; il 77,4% era di razza bianca/caucasica, il 17,8% nero/afroamericano, 1’1,9% asiatico, lo 0,5% indiano d’America/nativo dell’Alaska, lo 0,4% nativo hawaiano/altro gruppo del Pacifico, l’1,9% di altri gruppi razziali; e l’11,4% dei soggetti era di etnia ispanica/latino. La composizione demografica dei gruppi JYNNEOS e placebo era simile.
REAZIONI AVVERSE
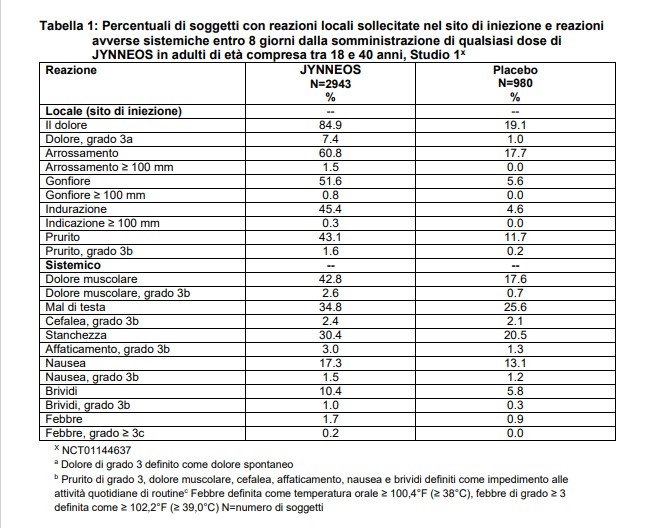
Nello Studio 1, i soggetti sono stati monitorati per le reazioni avverse locali e sistemiche utilizzando schede di diario per un periodo di 8 giorni a partire dal giorno di ogni vaccinazione. Le frequenze delle reazioni avverse locali e sistemiche sollecitate in seguito a qualsiasi dose di JYNNEOS sono riportate nella Tabella 1
EVENTI AVVERSI GRAVI
Le analisi integrate degli eventi avversi gravi (SAE) hanno raggruppato i dati di sicurezza di 22 studi, che hanno incluso un totale di 7.093 soggetti naïve al vaccino contro il vaiolo e 766 soggetti con esperienza di vaccino contro il vaiolo che hanno ricevuto almeno una dose di JYNNEOS e 1.206 soggetti naïve al vaccino contro il vaiolo che hanno ricevuto solo placebo. I SAE sono stati monitorati dal giorno della prima vaccinazione di studio fino ad almeno 6 mesi dopo l’ultima vaccinazione di studio.
Tra i soggetti naïve al vaccino antivaioloso, sono state segnalate SAE nell’1,5% dei riceventi JYNNEOS e nell’1,1% dei riceventi placebo. Tra soggetti con esperienza di vaccino antivaioloso arruolati in studi senza placebo di confronto, sono stati segnalati SAE nel 2,3% dei soggetti che hanno ricevuto JYNNEOS. In tutti gli studi, non è stato possibile escludere una relazione causale con JYNNEOS per 4 SAE, tutti non fatali, che includevano il morbo di Crohn, la sarcoidosi, la paresi dei muscoli extraoculari e la tensione alla gola.
EVENTI AVVERSI CARDIACI DI PARTICOLARE INTERESSE
La valutazione degli eventi avversi cardiaci di particolare interesse (AESI) ha incluso qualsiasi segno o sintomo cardiaco, alterazioni dell’ECG ritenute clinicamente significative o troponina-l elevata oltre 2 volte il limite superiore della norma. Nei 22 studi, i soggetti sono stati monitorati per segni o sintomi cardiaci per almeno 6 mesi dopo l’ultima vaccinazione.
I numeri dei riceventi JYNNEOS e placebo, rispettivamente, con dati sulla troponina-l sono stati: livello basale (6.376 e 1.203); livello due settimane dopo la prima dose (6.279 e 1.166); livello due settimane dopo la seconda dose (1.683 e 193); visita non programmata, anche per la valutazione clinica di sospetti eventi avversi cardiaci (500 e 60).
Le AESI cardiache si sono verificate nell’1,3% (95/7.093) dei riceventi JYNNEOS e nello 0,2% (3/1.206) dei riceventi placebo che erano naïve al vaccino antivaioloso. Le AESI cardiache si sono verificate nel 2,1% (16/766) dei destinatari di JYNNEOS che avevano sperimentato il vaccino antivaioloso. La percentuale più elevata di riceventi JYNNEOS che hanno sperimentato AESI cardiache è stata determinata da 28 casi di innalzamento asintomatico della troponina-l dopo la vaccinazione in due studi: Studio 5, che ha arruolato 482 soggetti con infezione da HIV e 97 soggetti sani, e lo Studio 6, che ha arruolato 350 soggetti con dermatite atopica e 282 soggetti sani. Nel corso del programma di sviluppo clinico sono stati documentati altri 127 casi di innalzamento asintomatico post-vaccinazione della troponina-l al di sopra del limite superiore di normalità, ma non oltre 2 volte il limite superiore di normalità, 124 dei quali si sono verificati nello Studio 5 e nello Studio 6. Le percentuali di soggetti con innalzamento della troponina-I erano simili tra soggetti sani e quelli infettati dall’HIV nello Studio 5 e tra i soggetti sani e quelli affetti da dermatite atopica nello Studio 6. In questi due studi è stato utilizzato un diverso dosaggio della troponina rispetto agli altri studi e questi due studi non avevano controlli con placebo. Il significato clinico di questi innalzamenti asintomatici della troponina-l dopo la vaccinazione non è noto.
Tra le AESI cardiache riportate, 6 casi (0.08%) sono stati considerati causalmente correlati alla vaccinazione JYNNEOS e comprendevano tachicardia, inversione dell’onda T dell’elettrocardiogramma, anomalia dell’elettrocardiogramma, innalzamento del segmento ST dell’elettrocardiogramma, anomalia dell’onda T dell’elettrocardiogramma e palpitazioni.
GRAVIDANZA
“I dati umani disponibili su JYNNEOS somministrato ingravidanza sono insufficienti per informare sui rischi associati al vaccino in gravidanza”
ALLATTAMENTO
“Non è noto se JYNNEOS sia escreto nel latte umano. Non sono disponibili dati per valutare gli effetti di JYNNEOS nel lattante allattato al seno o sulla produzione/escrezione di latte”
USO PEDIATRICO
“La sicurezza e l’efficacia non sono state stabilite nei soggetti con età inferiore a 18 anni”.
USO GERIATRICO
“Quarantadue adulti con esperienza di vaccino antivaioloso di età compresa tra 65 e 80 anni hanno ricevuto almeno una dose di JYNNEOS (Studio 4).
Gli studi clinici di JYNNEOS non hanno incluso un numero sufficiente di soggetti di età superiore ai 65 anni per stabilire se rispondano in modo diverso dai soggetti più giovani”.
TOSSICOLOGIA NON CLINICA
Carcinogenesi, mutagenesi, compromissione della fertilità
“JYNNEOS non è stato valutato per il potenziale cancerogeno o mutageno, né per la compromissione della fertilità maschile negli animali. Studi di tossicità per lo sviluppo condotti su ratti e conigli vaccinati con JYNNEOS non hanno rivelato alcuna evidenza di compromissione della fertilità femminile [vedere Uso in popolazioni specifiche”
LEGGI LA SCHEDA: Package Insert – JYNNEOS (fda.gov)
Fonte Eventi avversi

