Sono di questi giorni le notizie dell’ improvviso e preoccupante verificarsi di casi di epatite acuta di origine sconosciuta nei bambini.
L’allarme è partito all’inizio di questo mese dall’agenzia per la sicurezza sanitaria del Regno Unito (UKHSA) che ha rilevato tassi più elevati del solito di infiammazione del fegato (epatite) nei bambini.
La strana epidemia si è poi propagata velocemente ad altri paesi tanto che anche l’ OMS ha avviato un’ indagine.
I casi continuano ad aumentare così come la preoccupazione al riguardo e nel frattempo le autorità sanitarie si affrettano a scongiurare un possibile legame tra l’insorgere di queste anomale epatititi acute e la vaccinazione Covid. Ieri il Ministero della Salute dopo che le segnalazioni totali relative a casi di minori affetti da epatite acuta in Italia sono salite a 11, ha emanato una circolare dove assicura : “Epatite acuta bambini, nessun legame con il vaccino Covid”.
“Non è stato identificato alcun legame con il vaccino anti Covid-19 e un questionario somministrato ai casi, su alimenti e abitudini personali, non ha identificato alcuna esposizione comune”. È quanto si evidenzia nella circolare del ministero della Salute, a firma del direttore generale Prevenzione sanitaria, Giovanni Rezza.

E’ molto strana questa repentina alzata di scudi da parte delle autorità sanitarie, tanto strana da essere addirittura sospetta. D’altro canto siamo reduci da anni ormai di falsità, pericolose bugie e approssimazioni che ci hanno insegnato a osservare attentamente l’insorgere e l’evolversi degli eventi.
Ad esempio, chi è che non ricorda tutte le giravolte sul vaccino AstraZeneca?
- 2 e 10 febbraio 2021: AIFA e Ministero della Salute confermano il vaccino AstraZeneca agli under 55. Questo dopo che il 9 Febbraio il vice Ministro Pierpaolo Sileri dice che tale vaccino può essere somministrato agli under 55.
- 16-17-23 Febbraio: ok al vaccino fino a 65 anni.
- 7 Marzo 8 Marzo: il Ministro della Salute-Sanità, Roberto Speranza, dà l’ok per la somministrazione agli over 65.
- In Europa comincia a circolare la notizia di una correlazione tra vaccino AstraZeneca e trombosi; iniziano le sospensioni.
- Sempre a Marzo il presidente dell’AIFA, Giorgio Palù, contesta l’eccessiva emotività creata attorno al vaccino AstraZeneca.
- 15 Marzo: l’AIFA sospende in via precauzionale il vaccino AstraZeneca, decisione contestata dall’ex direttore esecutivo dell’EMA, Guido Rasi.
- Sempre a Marzo L’EMA dà il via libera al vaccino AstraZeneca.
- 21 Marzo: Franco Locatelli, componente del CTS, cita il Regno Unito come esempio di buoni risultati ottenuti con il vaccino AstraZeneca.
- 4 Aprile: Giovanni Rezza, componente del CTS: “I benefici sono nettamente superiori ai rischi, ma gli eventi avversi rari di trombosi non vanno sottovalutati”
- 7 Aprile: circola l’idea di vietare il vaccino AstraZeneca agli under 65; lo stesso giorno passa la raccomandazione di vaccinare solo agli over 60.
- 8 Aprile: frenata sul vaccino AstraZeneca per i più giovani.
- 23 Aprile: l’EMA fa sapere che il vaccino AstraZeneca va bene per tutte le fasce d’età.
- 3 Maggio: il Generale Francesco Paolo Figliuolo, commissario per l’emergenza Covid-19, valuta la somministrazione del vaccino AstraZeneca per gli under 60.
- 23 Maggio: l’AIFA definisce il vaccino AstraZeneca sicuro.
Poi il decesso della diciottenne Camilla Canepa e il resto è storia.
Ma torniamo ai casi di epatite acuta di origine sconosciuta nei bambini.
Molte potrebbero essere le correlazioni tra l’improvvisa epidemia di epatite e la vaccinazione Covid, ne abbiamo parlato QUI e sappiamo che la proteina spike si concentra in milza, fegato, ghiandole surrenali e ovaie in alte concentrazioni e tutto ciò è ormai supportato da numerosi studi e evidenze scientifiche.
Ma se la responsabile di questa patologia epatica non fosse solo la proteina spike ma anche le note nanoparticelle lipidiche (LNP)?
Le nanoparticelle lipidiche (LNP) utilizzate nella produzione di vaccini mRNA sono nuove nello sviluppo di vaccini e ci sono pochi dati sulla sicurezza per questa classe di sostanze. Tuttavia, sono necessarie per stabilizzare l’mRNA e per trasportarlo nel suo sito di azione. Gli LNP utilizzati, AL-0159 e Al-0315, sono ammine terziarie disponibili da vari produttori in tutto il mondo. Queste sostanze non sono destinate all’uso sull’uomo. Sono destinate esclusivamente a scopi sperimentali.
Il dottor Bruno Panzner che ha lavorato in cliniche, scienza e ricerca e ha trascorso 20 anni a fornire consulenza scientifica a uno dei principali produttori di vaccini, ha contattato il fornitore delle particelle nanolipidiche AL-0159 e Al-0315 Echelon Biosciences Inc, che ha risposto solo dopo che Panzner ha minacciato di avviare test tossicologici in Germania. Il “Vice President of Production” di questo produttore americano ha ammesso che entrambe le sostanze erano disponibili solo per la RICERCA SPERIMENTALE.
Indicazioni della pericolosità di questi LNP
“Somministrati per via intradermica, intramuscolare e nasale e dei tessuti esaminati dopo 24 ore. Dopo l’applicazione intramuscolare e intradermica, si sono verificate significative reazioni infiammatorie nel tessuto circostante. Dopo l’applicazione intranasale, si sono verificati significativi cambiamenti infiammatori nel tessuto polmonare e gli animali sono morti“.
Avvisi di pericolo
Un documento in Circolazione (2) fornisce chiare indicazioni sui potenziali pericoli. 566 pazienti sono stati seguiti per un periodo di 8 anni (iniziato ben prima della pandemia, vedi appendice). Dopo la vaccinazione con mRNA, nella maggior parte di questi pazienti è stato registrato un aumento dei biomarcatori proteici che indicano processi infiammatori. Gli autori concludono che la vaccinazione con mRNA provoca infiammazione dell’endotelio, aumenta notevolmente l’infiltrazione di cellule T nel miocardio e può spiegare un aumento del rischio di trombosi, sviluppo di cardiomiopatia e altri eventi vascolari dopo la vaccinazione.
Risultati dei patologi
Anche i risultati dei test del Prof. Arne Burkhard, Pathology Reutlingen (3), indicano gravi danni da vaccinazione. L’esperto patologo ha trovato alterazioni infiammatorie in un’ampia varietà di tessuti e organi come il cuore (miocardite), i polmoni, il cervello, il FEGATO e nei vasi di persone decedute in una connessione temporale con la vaccinazione.
Delle particelle nanolipidiche aveva discusso anche l’eurodeputata Francesca Donato che a gennaio di quest’anno aveva chiesto delucidazioni riguardo alla pericolosità della sostanza ALC-0315, e la conferma arriva proprio dalla scheda di sicurezza di Comirnaty Pfizer.
La Donato scriveva:
La scheda di sicurezza del Comirnaty
“Quindi per mia curiosità ho ricercato ed analizzato la scheda di sicurezza del vaccino Comirnaty della Pfizer-BioNTech. Come si evince dalla sezione 2 il prodotto viene classificato come non pericoloso.

Nella sezione 3 vengono riportati tutti i componenti e per ogni componente dovrebbe essere riportata la rispettiva classificazione di pericolo secondo il Regolamento CE 1272/2008 (CLP). Nella colonna riferita alla classificazione di pericolo viene riportato come componente pericoloso solo il potassio cloruro classificato come H303 Acute Tox 5 (che significa può essere nocivo in caso di ingestione), mentre per tutti gli altri componenti del vaccino viene indicata la frase “no data available”(tradotto in “nessun dato disponibile”).”
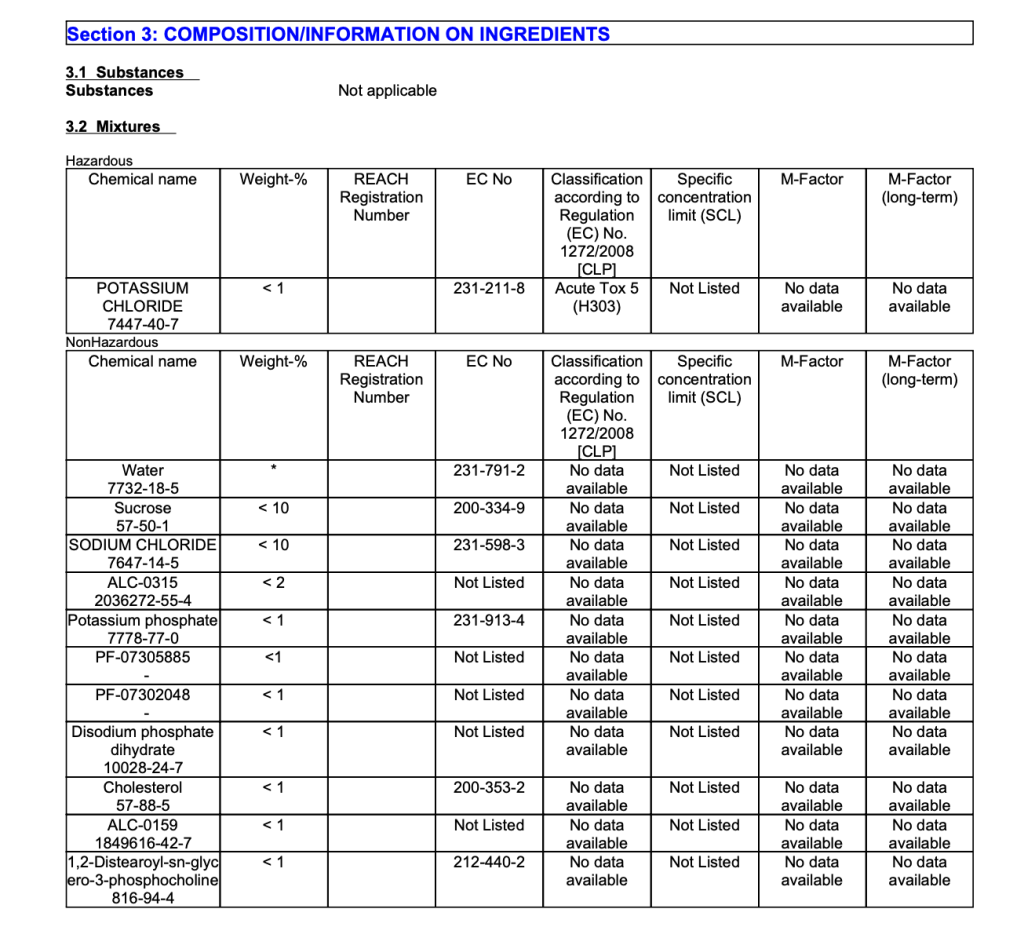
“Questa comune indicazione riportata per tutti i componenti del vaccino mi è apparsa subito strana cosicchè ho ricercato le schede di sicurezza dei componenti stessi ed ho reperito la scheda dell’eccipiente.”
La scheda di sicurezza di ALC-0315
“Innanzitutto vi segnalo che nella sezione 1 della scheda di sicurezza ALC-0315 in “applicazione della sostanza” viene riportato dal produttore stesso che il prodotto è ad uso di ricerca, non per uso diagnostico o terapeutico umano o animale.”

“Ma la caratteristica più importante del prodotto viene riportata nella sezione 2 “identificazione dei rischi”, infatti viene classificato come pericoloso, in particolare come Carc. 1A, ossia “può provocare il cancro”.”

“Come mai questa classificazione dell’eccipiente ALC 0315 non è stata riportata nella scheda di sicurezza del vaccino Comirnaty? In particolare nella sezione 3 nella colonna che dovrebbe riportare la classificazione di pericolo secondo il Regolamento CE 1272/2008 (CLP).
L’eccipiente ALC 0315 è un lipide sintetico che ingloba il principio attivo, quindi ha un ruolo molto importante nel vaccino. Ma se risulta pericoloso, perché non viene segnalato?”
Questo invece per quanto riguarda l’altro eccipiente ALC-0159 dove scriveva:
“Su questo eccipiente si sa molto poco in quanto è un prodotto abbastanza nuovo. Per cui ricorriamo, per saperne di più, alla stessa Pfizer. Ed in particolare al documento ufficiale della Pfizer con il quale ha richiesto all’EMA l’autorizzazione all’uso del farmaco. La parte relativa alla sostanza ALC-0159 si trova a pagina 55.
La Pfizer mette subito in chiaro che non sono stati effettuati studi sulla genotossicità o la carcinogenicità di questo elemento. Per genotossico si intende che possa danneggiare il DNA, mentre per carcinogenico, come è noto, si intende la tendenza a generare tumori.

Le ragioni per giustificare l’assenza degli studi è che, cito testualmente: “I componenti del vaccino sono lipidi ed RNA dai quali non ci si aspetta possano avere potenziale genotossico”.
Non ci sia aspetta? Lo studio dovrebbe servire proprio per verificare che quanto non ci si aspetta in realtà poi non accada realmente, prima che accada su milioni di persone e sia troppo tardi intervenire.
L’altra cosa che salta all’occhio nelle due righe precedenti è la precisazione, nella prima riga, che non sono stati effettuati studi di genotossicità e carcinoginogenicità, mentre nel rigo successivo viene scritto che non ci si aspetta da questo prodotto un potenziale genotossico, la carcinoginogenicità viene omessa.

Il motivo risulta chiaro, leggendo poco dopo. Il nuovo eccipiente ALC-0159, infatti, contiene frazioni (moiety) di acetammide. L’acettammide è una sostanza organica molto diffusa, utilizzata in ambiente industriale come solvente, in ragione della sua elevata solubilità in acqua. È notoriamente una sostanza cancerogena, nel 2005 la JECFA, un organismo della FAO ha vietato l’uso della sostanza per uso umano, in considerazine dei comprovati rischi cancerogenici e dei possibili rischi genotossici. Quindi probabilmente i biologi Pfizer non se la sono sentita di scrivere che non si aspettavano rischi di cancerogenicità.

La pericolosità dell’acetammide è facilmente verificabile in qualunque scheda di rischio. Qui ne trovate una a caso di un produttore italiano (scheda di sicurezza acetammide).

Riassumendo, sembrerebbe che la Pfizer non si aspetta che un eccipiente, contenente una sostanza cancerogena, possa avere un potenziale cancerogeno, e che l’EMA abbia ritenuto razionale questa credenza. Questo ottimismo ci rincuora.
Archiviato dunque il problema della cancerogenicità, viene rilevato che gli studi presenti in letteratura l’acetammide è associata a genotossicità (che ricordo sono danni genetici). Lo studio evidenzia che il rischio è solo per alte somministrazioni, il problema è dunque risolto perché sono raccomandate solo due dosi del vaccino. SOLO DUE DOSI?

Dunque, si aspettano danni molto bassi sul fronte genotossicità (ma non avevano detto che non se ne aspettavano?). E se li aspettano bassi perché sono raccomandate SOLO DUE DOSI del vaccino. Non sapremo mai, curiosità accademica, se quando scrivono “risk expected to be very low” si aspettano pochi danni in tanti pazienti o grandi danni in pochi pazienti. Come sanno gli esperti di sicurezza, in presenza di un fattore di rischio il rischio zero non esiste”.
-Adesso i booster sono arrivati a 5-
OCCHIO QUI:
“Dalle somministrazioni ai ratti si sono accorti che il 18% dell’ALC-0159 si accumula nel FEGATO.
Però possiamo stare tranquilli perché gli effetti rilevati quali fegato ingrossato, vacuolazione e livelli di γGT fortemente aumentati a >200% (γGT è un marcatore che misura eventuali danni epatici), non hanno portato a patogenesi grave nei ratti. Si presuppone, ma non ce lo dicono, che abbiano comunque generato patogenesi non gravi: sarebbe utile cosa per un biologo Pfizer è grave in ambito di patenogenesi epatica. In ogni caso il richiedente, minimizzando, ci tiene a precisare che i vacuoli non sono responsabilità dell’ALC-0159, ma di ALC-0315. Insomma, nella scheda relativa ad ALC-0159 difendono questo eccipiente scaricando le responsabilità su ALC-0315. Come se il problema fosse chi genera i problemi epatici, e non i problemi epatici in sé”.
Quindi i problemi epatici si erano verificati, eccome!
Concludiamo per il momento ( perchè seguiranno aggiornamenti) con l’assessment report dell’EMA riguardo la valutazione del vaccino Pfizer Comirnaty:

Nell’immagine sopra il documento sulla farmacocinetica relativa al vaccino Pfizer riporta:
“Il richiedente ha determinato la farmacocinetica dei due nuovi eccipienti LNP ALC-0315
(aminolipidi) e ALC-0159 (PEG-lipidi) nel plasma e nel FEGATO, nonché la loro eliminazione e metabolismo nei topi. Inoltre, la Richiedente ha studiato la biodistribuzione dei due nuovi lipidi (nei ratti) e la biodistribuzione di un RNA surrogato della luciferasi formulato con LNP nei topi (IV), così come il
biodistribuzione di una formulazione di mRNA di nanoparticelle lipidiche marcate con [3H] nei ratti (IM).
Non sono stati condotti studi tradizionali di farmacocinetica o di biodistribuzione con il vaccino
candidato BNT162b2.
Nello studio PF-07302048_06Jul20_072424, il richiedente ha utilizzato un metodo LC-MS/MS qualificato per supportare la quantificazione dei due nuovi eccipienti LNP. I metodi di bioanalisi sembrano essere adeguati caratterizzato e convalidato per l’uso negli studi GLP.
Studi PK con i due nuovi eccipienti LNP ALC-0315 e ALC-0159:
I ratti Wistar Han sono stati iniettati in bolo IV con RNA codificante la luciferasi formulato con LNP a 1 mg/kg e Concentrazioni di ALC-0315 e ALC-0159 rispettivamente a 15,3 mg/kg e 1,96 mg/kg. ALC-0315 e
I livelli di ALC-0159 nel plasma, nel FEGATO, nelle urine e nelle feci sono stati analizzati mediante LC-MS/MS in momenti diversi fino a 2 settimane”.
Abbiamo quindi una prova che la biodistribuzione delle nanoparticelle lipidiche TOSSICHE interessi il fegato, ma c’è di più:

Leggiamo:
“ALC-0315 e ALC-0159 sono stati rapidamente eliminati dal plasma durante le prime 24 ore con un t½ iniziale rispettivamente di 1,62 e 1,72 h. 24 ore dopo la somministrazione, meno dell’1% del plasma massimo le concentrazioni sono rimaste. Una velocità di eliminazione più lenta è stata osservata dopo 24 ore con ALC-0315 e Eliminazione terminale ALC-0159 t½ rispettivamente di 139 e 72,7 h.
Dopo la clearance plasmatica, il FEGATO sembra essere l’organo principale in cui ALC-0315 e ALC-0159
si distribuiscono Il richiedente ha stimato che la percentuale di dose distribuita al fegato è di circa il 60% per ALC-0315 e ~20% per ALC-0159. La distribuzione epatica osservata è coerente con le osservazioni di
lo studio sulla biodistribuzione e la tossicologia a dose ripetuta, entrambi mediante somministrazione IM.
Per ALC-0315 (aminolipide), la concentrazione massima rilevata nel fegato (294 μg/g di fegato) era
raggiunto 3 ore dopo l’iniezione endovenosa. ALC-0315 è stato eliminato lentamente dal fegato e dopo 2 settimane la concentrazione di ALC-0315 era ancora circa il 25% della concentrazione massima indicando che ALC-0315 verrebbero eliminati dal fegato di ratto in circa 6 settimane. Per ALC-0159 (PEG-lipidi), il massimo la concentrazione rilevata nel fegato (15,2 μg/g di fegato) è stata raggiunta 30 minuti dopo l’iniezione endovenosa.
ALC-0159, è stato eliminato dal fegato più velocemente di ALC-0315 e dopo 2 settimane la concentrazione di ALC-0159 era solo lo 0,04% circa della concentrazione massima rilevata. Al ricorrente è stato chiesto di discutere la lunga emivita di ALC-0315 e il suo effetto, discussione sul confronto con patisiran, come così come l’impatto sui boost e sulla durata della contraccezione post trattamento. Il richiedente ha considerato che non vi erano problemi di sicurezza non clinici sulla base degli studi di tossicità a dose ripetuta a dosi (su amg/kg) molto maggiore di quello somministrato all’uomo; questo era accettabile per il CHMP.
Entrambi i lipidi patisaran hanno mostrato un profilo farmacocinetico essenzialmente simile in clinica con un profilo fortemente bifasico e lunghe emivite terminali. Secondo la ricorrente, è difficile contestualizzare ulteriormente l’art dati di farmacocinetica e quindi per comprendere la sicurezza di queste molecole, oltre ogni considerazione di dose. C’è un ampio differenziale di dose tra la dose umana di BNT162b2 e la dose utilizzata nel studi di tossicità (300-1000x) che forniscono un margine di sicurezza accettabile.
Inoltre, secondo il richiedente, vista la grande differenza di dose tra gli studi di tossicità
e la dose clinicamente efficace (300-1000x), è improbabile che la somministrazione di una dose di richiamo porterà ad un notevole accumulo. Infine, il richiedente è del parere che questi risultati siano favorevoli nessun requisito per la contraccezione. Il CHMP ha ritenuto accettabile questa posizione.
Sebbene non vi fosse alcuna escrezione rilevabile di nessuno dei lipidi nelle urine, la percentuale della dose è stata escreta invariato nelle feci era ~ 1% per ALC-0315 e ~ 50% per ALC-0159“.
Quindi riassumendo:
- Le nanoparticelle lipidiche ALC-0315 e ALC-0159 sono contenute nel vaccino Pfizer
- Non sono state create per l’utilizzo sull’uomo, erano destinate esclusivamente a scopi sperimentali.
- Gli esperti patologi hanno riscontrato alterazioni infiammatorie in un’ampia varietà di tessuti e organi come il cuore (miocardite), i polmoni, il cervello, il FEGATO e nei vasi di persone decedute in una connessione temporale con la vaccinazione.
- Le nanoparticelle lipidiche ALC-0315 e ALC-0159 sono tossiche e potenzialmente cancerogene
- La Pfizer mette subito in chiaro che non sono stati effettuati studi sulla genotossicità o la carcinogenicità di queste sostanze
- Dalle somministrazioni nei ratti si sono accorti che il 18% dell’ALC-0159 si accumula nel FEGATO
- Durante la sperimentazione le nanoparticelle lipidiche hanno portato a patogenesi epatica nei ratti
- Le nanoparticelle lipidiche ALC-0315 e ALC-0159 si accumulano soprattutto nel FEGATO raggiungendo cocentrazioni massime e qui persistono molto a lungo
- L’emivita (tempo necessario a un farmaco per essere eliminato dal corpo) delle nanoparticelle lipidiche è SCONOSCIUTA COSI’ COME IL SUO EFFETTO SULLA SALUTE.
Si direbbe che abbiamo raccolto dati sufficienti per avanzare quantomeno qualche dubbio sulle implicazioni delle nanoparticelle lipidiche nell’insorgere di queste anomale epatiti acute nei bambini.
Voi che ne pensate?
Fonte Eventi Avversi

